Obsah
V anorganická chemie, hovoří se o Sůl když mluvíme o sloučeniny, které se získají, když má kyselina atomy vodíku nahrazeny bazickými radikály, který v konkrétním případě kyselé soli, jsou negativního typu (kationty). V tom se odlišují od neutrální soli nebo binární soli.
Solí se obvykle tvoří reakcí mezi kyselinou a hydroxidem (zásadou). Při těchto reakcích normálně báze ztrácí své hydroxylové skupiny (-OH) a kyselina atomy vodíku (H), čímž vytváří neutrální sůl; ale pokud dotyčná kyselina konzervuje jeden ze svých atomů vodíku a mění elektrický náboj reakce, získáme a kyselá sůl nebo hydrogenovaná sůl.
Tak se například hydrogenuhličitan lithný získává z hydroxidu lithného a kyseliny uhličité:
LiOH + H2CO3 = Li (HCO3) + H2NEBO
Reakce, jak bude vidět, také vrhá vodu jako vedlejší produkt.
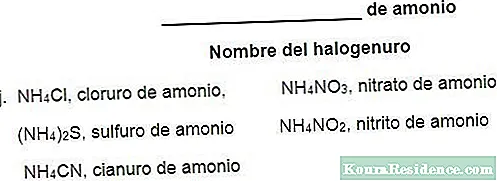
Názvosloví kyselých solí
Podle funkční nomenklatury by se u kyselých solí měl používat tradiční způsob pojmenování neutrálních solí od přípon -ate nebo -ite, ale s předponou označující počet atomů vodíku, které byly substituovány v molekula. Tak například hydrogenuhličitan lithný (LiHCO3) bude mít dva atomy vodíku (bi = dva).
Na druhé straně, podle systémové nomenklatury, termín vodík na běžný název získané soli, respektovat předpony, které odkazují na nahrazené atomy vodíku. Hydrogenuhličitan lithný nebo hydrogenuhličitan lithný tedy budou způsoby, jak pojmenovat stejný hydrogenuhličitan lithný (LiHCO3).
Příklady kyselých solí
- Hydrogenuhličitan sodný (NaHCO3). Nazývá se také hydrogenuhličitan sodný (IV), jedná se o bílou krystalickou pevnou látku rozpustnou ve vodě, kterou lze v přírodě najít v minerálním stavu nebo ji lze vyrobit v laboratoři. Je to jedna z nejkyselejších známých solí a je široce používána v cukrářských, farmaceutických nebo jogurtových výrobcích.
- Hydrogenuhličitan lithný (LiHCO3). Tato kyselá sůl byla použita jako zachycovací činidlo pro CO2 v situacích, kdy je takový plyn nežádoucí, jako v severoamerických vesmírných misích „Apollo“.
- Dihydrogenfosforečnan draselný (KH2PO4). Krystalická pevná látka, bez zápachu, snadno rozpustná ve vodě používá se v různých průmyslových odvětvích, jako jsou potravinářské droždí, chelatační činidla, nutriční posilující látky a pomocné látky při fermentačních procesech.
- Hydrogensíran sodný (NaHSO4). Kyselinová sůl vytvořená neutralizací kyseliny sírové, která se běžně průmyslově používá při rafinaci kovů, čisticích prostředcích, a přestože je vysoce toxická pro některé ostnokožce, používá se jako přísada do krmiva pro zvířata v zájmovém chovu a při výrobě šperků.
- Sírovodík sodný (NaHS). Nebezpečná směs jemného zacházení, protože je vysoce korozivní a toxická. Může to způsobit těžké popáleniny kůže a poškození očí, protože je také hořlavé.
- Hydrogenfosforečnan vápenatý (CaHPO4). Používá se jako doplněk stravy v obilovinách a krmivech pro hospodářská zvířata, je to pevná látka nerozpustná ve vodě, ale schopná krystalizace, když je hydratována konzumací dvou molekul vody.
- Hydrogenuhličitan amonný ([NH4] HCO3). Je známý jako hydrogenuhličitan amonný a používá se v potravinářském průmyslu jako chemické kvasinkyI když to má tu nevýhodu, že zachycuje amoniak, což při špatném používání zhoršuje chuť jídla. Používá se také v hasicích přístrojích, při výrobě pigmentů a jako gumový expandér.
- Hydrogenuhličitan barnatý (Ba [HCO3]2). Kyselá sůl, která při zahřátí může zvrátit svou produkční reakci a je vysoce nestabilní, kromě roztoku. Široce se používá v keramickém průmyslu.
- Hydrogensiřičitan sodný (NaHSO3). Tato sůl je extrémně nestabilní a v přítomnosti kyslíku se uvolňuje do síranu sodného, a proto se používá v potravinářském průmyslu jako konzervační prostředek a vysoušedlo. Je to extrémní redukční prostředek a běžně používaný člověkem, který se také používá k fixaci barev.
- Citrát vápenatý (Ca3[C6H5NEBO7]2). Běžně se označuje jako hořká sůl a používá se jako konzervační látka a jako doplněk výživy, pokud je spojen s aminokyselinou lysin. Je to bílý krystalický prášek bez zápachu.
- Fosforečnan vápenatý(Ca [H2PO4]2). Bezbarvá pevná látka získaná reakcí hydroxidu vápenatého a kyseliny fosforečné, Je široce používán jako kypřící prostředek nebo jako hnojivo při zemědělských pracích.
- Fosforečnan vápenatý (CaHPO4). Také známý jako monohydrogenfosforečnan vápenatý, má tři různé krystalické formy Používají se jako přísada do jídel a je přítomna v zubních pastách. Kromě toho se přirozeně tvoří v ledvinových kamenech a v takzvaném zubním „kameni“.
- Fosforečnan hořečnatý (MgH4P2NEBO8). Používá se jako okyselující látka, látka upravující kyselost nebo činidlo při zpracování mouky, je to krystalická bílá sůl bez zápachu, částečně rozpustná ve vodě a používá se při konzervování potravin.
- Diacetát sodný (NaH [C.2H3NEBO2]2). Tato sůl se používá jako ochucovadlo a konzervační látka pro jídla, zabraňující nebo zpožďující výskyt hub a mikrobakterií, a to jak ve vakuově balených výrobcích, jako jsou masné výrobky, tak v moučném průmyslu.
- Hydrogenuhličitan vápenatý (Ca [HCO3]2). Hydrogenovaná sůl, která pochází z uhličitanu vápenatého, přítomného v minerálech, jako je vápenec, mramor a další. Tato reakce znamená přítomnost vody a CO2, takže se může objevit spontánně v jeskyních a jeskyních bohatých na vápník.
- Fluorid kyseliny rubidiové (RbHF). Tato sůl se získává reakcí kyseliny fluorovodíkové (vodík a fluor X) a Rubidia, alkalického kovu. Výsledkem je toxická a korozivní sloučenina, se kterou je nutno zacházet opatrně..
- Fosforečnan amonný ([NH4] H2PO4). Ve vodě rozpustná sůl vyráběná reakcí amoniaku a kyseliny fosforečné používá se jako hnojivo, protože poskytuje půdě dusíkaté a fosforové živiny nezbytné pro růst rostlin. Je také součástí prášku ABC v hasicích přístrojích.
- Hydrogenorthoboritan zinečnatý(Zn [HBO3]). Sůl používaná jako antiseptikum a jako přísada při výrobě keramiky.
- Fosforečnan sodný (NaH2PO4). Používá se více než cokoli v laboratořích, například „nárazník„Nebo pufrovací roztok, který zabrání náhlým změnám pH roztoku.
- Hydrogenftalát draselný (KHP). Také se nazývá ftalát kyseliny draselné, jedná se o pevnou a stabilní sůl v běžném vzduchu, takže se často používá jako primární standard při měření pH. Je to také užitečné jako agent vyrovnávací paměti v chemické reakce.
Může vám sloužit:
- Příklady minerálních solí a jejich funkce
- Příklady neutrálních solí
- Příklady solí Oxisales


